PhysProf - Isotherme Zustandsänderung - Boyle Mariotte - Leistung

Fachthemen: Isotherme Zustandsänderung
Boyle-Mariottesches Gesetz - Thermische Leistung - Volumenarbeit - Volumenänderungsarbeit
PhysProf - Wärmelehre - Ein Programm zur Visualisierung von Sachverhalten aus verschiedenen Teilgebieten der Physik mittels Simulationen und 2D-Computeranimationen für das Studium sowie für Lehrer, Ingenieure und alle die sich hierfür interessieren. Neben dem Einsatz zur Durchführung wissenschaftlicher Untersuchungen kann es als Lernprogramm für Schüler der Oberstufe Anwendung finden.
Online-Hilfe für das Modul
zur grafischen Darstellung und Untersuchung des Prozessablaufs bei isothermen Zustandsänderungen.
Dieses Teilprogramm ermöglicht die Durchführung interaktiver Analysen zu diesem Fachthema sowie eine Untersuchung der entsprechenden physikalischen Sachverhalte.
Es unterstützt dabei ein tiefergehendes Verständnis zu diesem Themengebiet zu erlangen und kann zum Lösen vieler diesbezüglich relevanter Aufgaben eingesetzt werden.

Weitere relevante Seiten zu diesem Programm

Themen und Stichworte zu diesem Modul:Isothermer Prozess - Isotherme Kompression - Isotherme Expansion - Isotherme Zustandsänderung - Konstante Temperatur - Thermische Leistung - Volumen - Druck - Gas - Gasvolumen - Gasdruck - Thermodynamik - Grundlagen - Verdichtung - Ausdehnung - Gaskonstante - Isotherm - Entropieänderung - Gesetz von Boyle Mariotte - Boyle-Mariotte - Gesetz - Boyle-Mariottesches Gesetz - Boylesches Gesetz - Gesetz von Charles - Herleitung - Beweis - Volumenänderungsarbeit - Wärmeenergie - Arbeit - Temperatur - Diagramm - Energie - Einheit - Physikalische Einheit - pV-Diagramm - pV Diagramm - Druckänderungsarbeit - Druckänderung - Druckarbeit - Technische Arbeit - Physik - Physikalisch - Grundlagen - Definition - Was - Wie - Weshalb - Was ist - Warum - Bedeutung - Was bedeutet - Erklärung - Einfach erklärt - Einführung - Beschreibung - Arbeitsblatt - Arbeitsblätter - Unterrichtsmaterial - Unterrichtsmaterialien - Lernen - Erlernen - Aufgaben - Lösungen - Abituraufgaben - Abiturvorbereitung - Abitur - Abi - Leistungskurs - LK - Klassenarbeit - Klassenarbeiten - Anwendungsaufgaben - Erwärmung - Begriff - Begriffe - Verändern - Veränderung - Ändern - Änderung - Beispiel - Prozess - Tabelle - Berechnen - Verdichtung - Ablauf - Abläufe - Vorgang - Vorgänge - Untersuchen - Gleichungen - Volumenarbeit - Ausdehnungsarbeit - Expansionsarbeit - Rechner - Formeln - Formelzeichen - Animation - Simulation - Bild - Grafik - Berechnung - Darstellen - Grafische Darstellung |
 |  |
Isotherme Zustandsänderung
Modul Isotherme Zustandsänderung
PhysProf ermöglicht neben der Anwendung als Visualisierungsprogramm die Durchführung von Untersuchungen zu Grundlagen sowie die Aneignung fundamentierten Fachwissens zu verschiedenen Themengebieten der Thermodynamik.
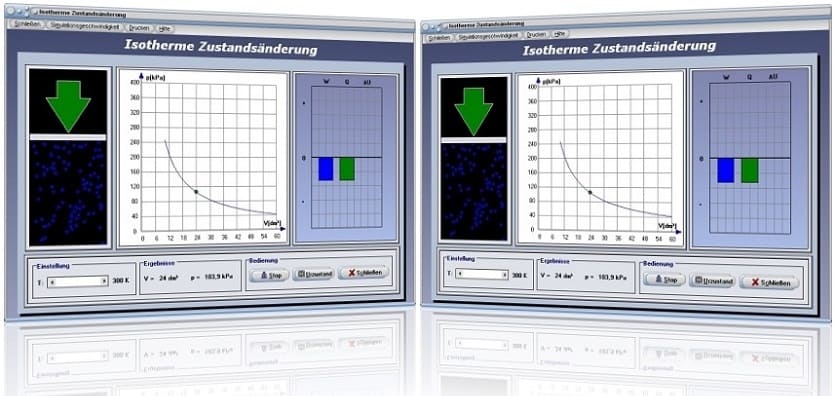
Das Unterprogramm [Thermodynamik] - [Isotherme Zustandsänderung] demonstriert den Prozessablauf einer isothermen Zustandsänderung bei einem realen Gas.

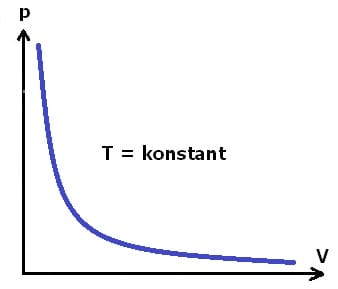
Isotherme Zustandsänderung - Abbildung 1

Isotherme Zustandsänderung - Abbildung 2
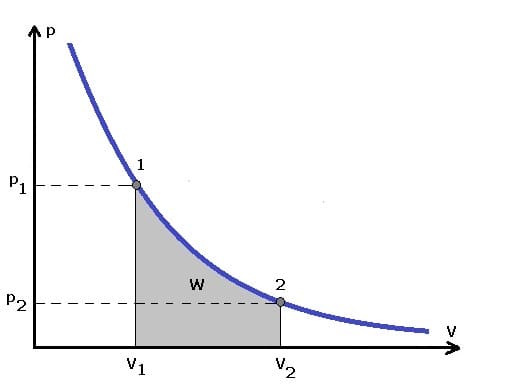
Isotherm wird eine Zustandsänderung bezeichnet, bei welcher die Temperatur unverändert bleibt. Bei einer isothermen Zustandsänderung wandelt sich die zugeführte Energie restlos in mechanische Arbeit um. Eine derartige Zustandsänderung wird auch als isothermer Prozess bezeichnet. Eine isotherme Expansion führt zu einer Erhöhung des Volumens des Systems bei konstanter Temperatur. Eine isotherme Kompression reduziert das Volumen des Systems bei konstanter Temperatur. Für eine isotherme Zustandsänderung gilt:

Nach dem Gesetz von Boyle-Mariotte und der Zustandsgleichung eines idealen Gases bleibt das Produkt aus Druck p und dem Volumen V bei konstanter Temperatur konstant. Es gilt:


Für die Wärmeenergie gilt:

Für die verrichtete Arbeit gilt:

Für die Änderung der inneren Energie gilt:

Hierbei sind:
p1: Druck im Anfangszustand [Pa]
p2: Druck im Endzustand [Pa]
V1: Volumen im Anfangszustand [m³]
V2: Volumen im Endzustand [m³]
ΔT: Temperaturänderung [K]
W: Verrichtete Arbeit [J]
Q: Wärmeenergie [J]
ΔU: Änderung der inneren Energie [J]
m: Gasmasse [kg]
R: Gaskonstante [J/(kgK)]
T: Gastemperatur [K]
Die folgende Grafik stellt das pv-Diagramm einer isothermen Zustandsänderung dar.
Programmbedienung
Durch die Positionierung des Schiebereglers T kann eine konstante Temperatur eingestellt werden. Nach der Bedienung der Schaltfläche Start wird das pV-Diagramm für einen isothermen Prozess gezeichnet. Am dargestellten Energiediagramm werden die Änderung der inneren Energie ΔU, die dem System zugeführte Wärmeenergie Q und die am System verrichtete Arbeit W ausgegeben.
Beim Prozess einer isothermen Expansion verändert sich die innere Energie des idealen Gases nicht und die gesamte erreichte Wärme wird in Arbeit gewandelt.
Übersicht - Formeln
Die nachfolgende Tabelle zeigt Formeln, die bei einer isothermen Zustandsänderung Gültigkeit haben.
| Bedingung | ΔT = 0 dT = 0 |
| 1. Hauptsatz | Q = -W dQ = -dW |
| Druck, Volumen, Temperatur p,V,T | 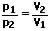 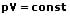 |
| Wärmeenergie | Q = -W dQ = -dW |
| Arbeit | W = p1V1 ln(p2/p1) W = p1V1 ln(V1/V2) W = p2V2 ln(p2/p1) W = p2V2 ln(V1/V2) dw = -p dV |
| Entropieänderung | ΔS = mR ln(V2/V1) ΔS = mR ln(p1/p2) 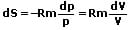 |
| Änderung innerer Energie | ΔU = 0 dU = 0 |
Boyle-Mariottesches Gesetz
Das Gesetz von Boyle Mariotte (Boyle-Mariottesches Gesetz, Boylesches Gesetz oder Gesetz von Charles) besagt, dass wenn ein ideales Gas bei konstanter Temperatur und gleichzeitig bei gleichbleibender Stoffmenge gehalten wird, so ist dessen Druck umgekehrt proportional zum Volumen V des Gases. Dies ist gleichbedeutend mit der Tatsache, dass bei einem geschlossenen Gas bei konstanter Temperatur Druck und Dichte zueinander proportional sind. Zustandsänderungen dieser Art werden als isotherm bezeichnet.
Es gilt:

p1: Anfangsdruck des Gases [Pa]
p2: Enddruck des Gases [Pa]
V1: Anfangsvolumen des Gases [m³]
V2: Endvolumen des Gases [m³]
Thermische Leistung
Bei der thermischen Leistung handelt es sich um eine physikalische Größe, durch welche die innerhalb eines Zeitraums umgesetzte Wärmeenergie angegeben wird. Für die thermische Leistung gilt:
P = Q/t
P: Thermische Leistung [J/s]
Q: Umgesetzte Wärmeenergie [J]
t: Zeit [s]
Volumenarbeit - Volumenänderungsarbeit - Druckänderung - Druckänderungsarbeit - Technische Arbeit
Die Volumenarbeit (Volumenänderungsarbeit oder Ausdehnungsarbeit bzw. Expansionsarbeit) ist die an einem geschlossenen System zu leistende Arbeit W12 um dessen Volumen V1 auf das Volumen V2 zu verdichten oder auszudehnen. Bei einer Verkleinerung des Volumens (einer Verdichtung) (V2 < V1) wird Arbeit in Form von Kompression verrichtet, bei einer Vergrößerung (einer Ausdehnung) dessen (V2 > V1) erfolgt dies durch Expansion.
Bei einem reibungsfreien Vorgang in einem Zylinder kann die Volumenarbeit W12 wie folgt berechnet werden:
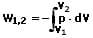
denn es gilt hierbei:
F = p·A und dV = A·ds
Beim Vorliegen einer isothermen Expansion kann das oben gezeigte Integral durch das Einsetzen der Zustandsgleichung idealer Gase
p(V) = n·R·T·1/V
wie nachfolgend gezeigt gelöst werden:
W1,2 = -n·R·T·ln (V2/V1) = n·R·T·ln (V1/V2)
Als Druckänderungsarbeit (Druckarbeit) oder technische Arbeit wird die die von der Druckkraft an einem System verrichtete Arbeit bezeichnet. Bei einer isothermen Zustandsänderung entspricht die Druckänderungsarbeit (technische Arbeit) der Volumenänderungsarbeit.
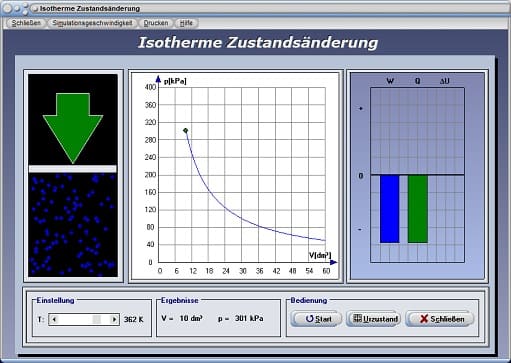
Isotherme Zustandsänderung - Abbildung 3
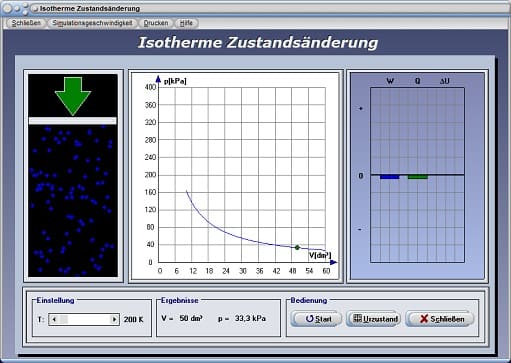
Isotherme Zustandsänderung - Abbildung 4
Mit Hilfe dieses Programms lassen sich unter anderem Grafiken für Arbeitsblätter zur nichtkommerziellen Nutzung für Unterrichtszwecke erstellen. Beachten Sie hierbei jedoch, dass jede Art gewerblicher Nutzung dieser Grafiken und Texte untersagt ist und dass Sie zur Verfielfältigung hiermit erstellter Arbeitsblätter und Unterrichtsmaterialien eine schriftliche Genehmigung des Autors (unseres Unternehmens) benötigen.
Diese kann von einem registrierten Kunden, der im Besitz einer gültigen Softwarelizenz für das entsprechende Programm ist, bei Bedarf unter der ausdrücklichen Schilderung des beabsichtigten Verfielfältigungszwecks sowie der Angabe der Anzahl zu verfielfältigender Exemplare für das entsprechende Arbeitsblatt unter der auf der Impressum-Seite dieses Angebots angegebenen Email-Adresse eingeholt werden. Es gelten unsere AGB.
Dieses Programm eignet sich neben seinem Einsatz als Berechnungs- bzw. Animationsprogramm zudem zum Lernen, zur Aneignung entsprechenden Fachwissens, zum Verstehen sowie zum Lösen verschiedener Aufgaben zum behandelten Fachthema. Durch seine einfache interaktive Handhabbarkeit bietet es die auch Möglichkeit der Durchführung unterschiedlicher Untersuchungen hierzu. Des Weiteren eignet es sich beim Üben dazu, um das Erlernte hinsichtlich praktizierter Übungen bzw. bearbeiteter Übungsaufgaben zu überprüfen und hierzu erworbenes Wissen festigen zu können.
Es kann sowohl zur Einführung in das entsprechende Fachthemengebiet, wie auch zur Erweiterung des bereits hierzu erlangten Fachwissens sowie als Unterstützung bei der Bearbeitung von Anwendungsaufgaben genutzt werden. Des Weiteren eignet es sich auch als Begleiter bei der Bearbeitung von Abituraufgaben sowie zur Vorbereitung auf Klassenarbeiten, zur Unterstützung bei der Abiturvorbereitung und zur Intensivierung des erforderlichen Wissens beim Abitur (Abi) im entsprechenden Leistungskurs (LK).
Mittels der anschaulichen Gestaltung und einfachen Bedienbarbarkeit einzelner Module dieser Software können Fragen zum entsprechenden Themengebiet, die mit den Worten Was ist?, Was sind?, Wie?, Wieviel?, Was bedeutet?, Weshalb?, Warum? beginnen beantwortet werden.
Eine Herleitung dient dazu, zu erklären, weshalb es zu einer Aussage kommt. Derartige Folgerungen sind unter anderem dazu nützlich, um zu verstehen, weshalb eine Formel bzw. Funktion Verwendung finden kann. Dieses Modul kann auch in diesem Fall hilfreich sein und ermöglicht es durch dessen Nutzung oftmals, einer entsprechenden Herleitung bzw. einem Beweis zu folgen, oder einen Begriff zum entsprechenden Fachthema zu erklären.
Bei Fragen deren Wörter Welche?, Welcher?, Welches?, Wodurch? bzw. Wie rechnet man? oder Wie berechnet man? sind, können zugrunde liegende Sachverhalte oftmals einfach erklärt und nachvollzogen werden. Auch liefert diese Applikation zu vielen fachthemenbezogenen Problemen eine Antwort und stellt eine diesbezüglich verständliche Beschreibung bzw. Erklärung bereit.
Eine kleine Übersicht in Form von Bildern und kurzen Beschreibungen über einige zu den einzelnen Fachthemengebieten dieses Programms implementierte Unterprogramme finden Sie unter Kurzbeschreibungen von Modulen zum Themengebiet Mechanik - Kurzbeschreibungen von Modulen zum Themengebiet Elektrotechnik - Kurzbeschreibungen von Modulen zum Themengebiet Optik - Kurzinfos zum Themengebiet Thermodynamik sowie unter Kurzbeschreibungen von Modulen zu sonstigen Themengebieten.
Hilfreiche Informationen zu diesem Fachthema sind unter Wikipedia - Isotherme Zustandsänderung zu finden.
Nachfolgend finden Sie ein Video zu diesem Fachthema, welches Sie durch die Ausführung eines Klicks
auf die nachfolgend gezeigte Grafik abspielen lassen können.
Schräger Wurf - Schiefer Wurf, Waagerechter Wurf - Horizontaler Wurf, Hookesches Gesetz, Mechanische Arbeit, Zweites Newtonsches Gesetz, Drittes Newtonsches Gesetz, Gedämpfte mechanische Schwingung, Bewegungen auf einer Kreisbahn, Hebelgesetz, Chaotisches Doppelpendel, Mathematisches Pendel, Freier Fall und Luftwiderstand, Harmonische Schwingungen, Molekularbewegungen, Brownsche Bewegungen, Potentielle und kinetische Energie, Ideale Strömung - Volumenstrom, Druck in Flüssigkeiten, Wellen - Simulationen, Zusammengesetzte Bewegung, Bewegungen in der Ebene, Carnotscher Kreisprozess, Adiabatische Zustandsänderung, Isotherme Zustandsänderung, Isobare Zustandsänderung, Isochore Zustandsänderung, Beugung am Spalt, Hohlspiegel, Sammellinse, Zerstreuungslinse, Wechselstromkreise, RLC-Kreis - RLC-Schaltung, RL-Kreis - RL-Schaltung, RC-Kreis - RC-Schaltung, Resonanz - Resonanzkurve, Widerstände im Wechselstromkreis, Schwingungen und deren Überlagerung, Plattenkondensator, Ladung und Entladung von Kondensatoren, Reihenschaltung und Parallelschaltung, Lissajou-Figuren, 1. Keplersches Gesetz, 2. Keplersches Gesetz, 3. Keplersches Gesetz
Isochore Zustandsänderung - Isobare Zustandsänderung - Adiabatische Zustandsänderung - Carnotscher Kreisprozess - Aggregatzustände - Mischungsregel - Reales Gas - Molekülgeschwindigkeit
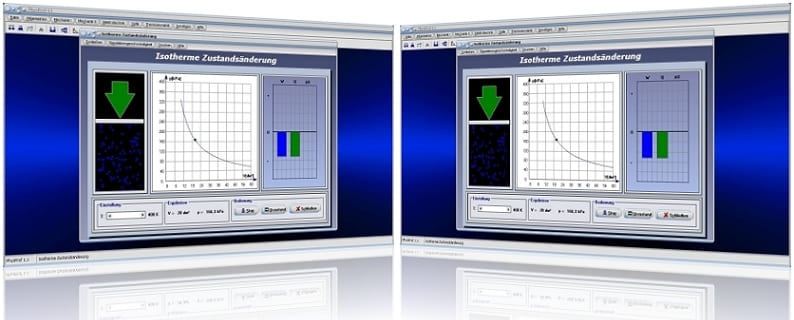
Unterprogramm Isotherme Zustandsänderung
PhysProf 1.1 - Unterprogramm RLC-Kreis
MathProf 5.0 - Unterprogramm Kurven in Parameterform

SimPlot 1.0 - Grafik- und Animationsprogramm für unterschiedlichste Anwendungszwecke
Nachfolgend finden Sie ein Video zu einem in PhysProf 1.1 unter dem Themenbereich Mechanik eingebundenen Unterprogramm,welches Sie durch die Ausführung eines Klicks auf die nachfolgend gezeigte Grafik abspielen lassen können.
Nachfolgend finden Sie ein Video zu einem in PhysProf 1.1 unter dem Themenbereich Elektrotechnik eingebundenen Unterprogramm, welches Sie durch die Ausführung eines Klicks auf die nachfolgend gezeigte Grafik abspielen lassen können.
Nachfolgend finden Sie ein Video zu einem in PhysProf 1.1 unter dem Themenbereich Thermodynamik eingebundenen Unterprogramm, welches Sie durch die Ausführung eines Klicks auf die nachfolgend gezeigte Grafik abspielen lassen können.
Nachfolgend finden Sie ein Video zu einer mit SimPlot 1.0 erstellten Animationsgrafik, welches Sie durch die Ausführung eines Klicks auf die nachfolgend gezeigte Grafik abspielen lassen können.
Nachfolgend finden Sie ein Video zu einer mit SimPlot 1.0 erstellten Animationsgrafik, welches Sie durch die Ausführung eines Klicks auf die nachfolgend gezeigte Grafik abspielen lassen können.
Nachfolgend finden Sie ein Video zu einer mit SimPlot 1.0 erstellten Animationsgrafik, welches Sie durch die Ausführung eines Klicks auf die nachfolgend gezeigte Grafik abspielen lassen können.